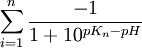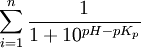wersja angielska |
|
Odrobina teorii:
Punkt
izoelektryczny (pI)
to wartość pH w którym suma ładunków
elektrostatycznych
cząsteczki wynosi zero. W przypadku białek zależy ona
głównie od
siedmiu naładowanych aminokwasów: kwasu glutaminowego (grupa
δ-karboksylowa), kwasu asparaginowego (grupa ß-
karboksylowa), cysteiny (grupa tiolowa), tyrozyny (grupa fenolowa),
histydyny (pierścień imidazolowy), lizyny (grupa
ε-amidowa) i
argininy (grupa guanidynowa). Ponadto wpływ mają także grupy NH
2
i COOH znajdujące się na końcach białka. Każda z nich charakteryzuje
się inną wartością stałej dysocjacji
pK.
Ładunek elektryczny białka odnosi się do pH roztworu (bufor) w
którym się ono znajduję w związku z czym ma ono także wpływ
na
obliczanie pI. Uwzględniając te wszystkie parametry i wykorzystując
równanie
Hendersona-Hasselbacha możemy wywnioskować następujące wzory
pozwalające obliczyć ładunek cząsteczki w określonym pH buforu:
- dla cząsteczek
obdarzonych ładunkiem ujemnym:
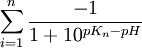
gdzie pKn
oznacza wartość pK analizowanego aminokwasu zawierającego grupę
negatywną
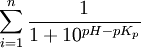
gdzie pKp
oznacza wartość pK analizowanego aminokwasu zawierającego grupę
pozytywną
Jak widać z równań jedyną zmienną jest pH buforu. Zmieniając
jego wartość możemy ustalić punkt izoelektryczny danego białka.
Wyznaczenie tej wartości ma duże znaczenie w biochemii w technikach
elektroforetycznych i ogniskowaniu izoelektrycznym, ponieważ umożliwia
dobranie odpowiedniego środowiska.
Ogólnie w pH poniżej pI białka mają ładunek dodatni, zaś
powyżej
ich ładunek jest ujemny. Ma to duże znaczenie w czasie rozdziału metodą
elektroforezy. pH żelu elektroforetycznego zależy od użytego buforu.
Jeżeli pH buforu jest wyższe od pI białka, to będzie ono migrować w
kierunku anody (ujemny ładunek jest przyciągany do niej). Z drugiej
strony jeśli pH buforu jest niższe od pI białka będzie ono się poruszać
w kierunku ujemnie naładowanej stronie żelu. Białko nie będzie migrować
jeśli pH buforu i pI danego białka będą sobie równe.
Stosując powyższe wzory możemy obliczyć teoretyczny punkt
izoelektryczny. Pisze teoretyczny, ponieważ wartość wyliczona będzie
prawie na pewno odbiegać od zaobserwowanej z kilku względów.
Po
pierwsze samo założenie, że pI zależy jedynie od wartości pK
wspomnianych wyżej aminokwasów jest raczej uproszczeniem.
Nie
bierzemy także pod uwagę modyfikacji białek, które mogą
modyfikować ładunek białka (np. fosforylacja). Problematyczna jest
także obecność cysteiny, ponieważ jeśli tworzy ona mostki siarczkowe to
takich cystein nie należy brać pod uwagę przy obliczeniach. Pomimo tych
wad można teoretycznie wyliczyć pI z dokładnością plus minus 0.5.
Krytycznym momentem wyznaczania punktu
izoelektrycznego jest użycie odpowiednich wartości pK. W tym przypadku
mamy
spory wybór. Poniżej przedstawiono przykładowe wartości
według różnych
źródeł:
|
Aminokwas |
NH2 |
COOH |
C |
D |
E |
H |
K |
R |
Y |
| EMBOSS |
8.6 |
3.6 |
8.5 |
3.9 |
4.1 |
6.5 |
10.8 |
12.5 |
10.1 |
| DTASelect |
8.0 |
3.1 |
8.5 |
4.4 |
4.4 |
6.5 |
10.0 |
12.0 |
10.0 |
| Solomon |
9.6 |
2.4 |
8.3 |
3.9 |
4.3 |
6.0 |
10.5 |
12.5 |
10.1 |
| Sillero |
8.2 |
3.2 |
9.0 |
4.0 |
4.5 |
6.4 |
10.4 |
12.0 |
10.0 |
| Rodwell |
8.0 |
3.1 |
8.33 |
3.68 |
4.25 |
6.0 |
11.5 |
11.5 |
10.07 |
| Patrickios |
11.2 |
4.2 |
- |
4.2 |
4.2 |
- |
11.2 |
11.2 |
- |
| Wikipedia |
8.2 |
3.65 |
8.18 |
3.9 |
4.07 |
6.04 |
10.54 |
12.48 |
10.46 |
Posiadając tych kilka wiadomości możemy się pokusić o napisanie
prostego programu obliczającego punkt izoelektryczny. Program ten
napiszemy w języku C++ korzystając z darmowego kompilatora
DevC++.
Czytanie dalszej części ma sens jedynie, gdy czytelnik posiada
podstawową wiedzę z zakresu programowania w tym języku.